Saure und basische Lösungen:
Hier erhältst du eine Kurzzusammenfassung über saure und basische Lösungen.
Saure Lösung:
Eine saure Lösung entsteht, wenn sich ein Nichtmetalloxid (Schwefel, Phosphor) mit Wasser verbindet.
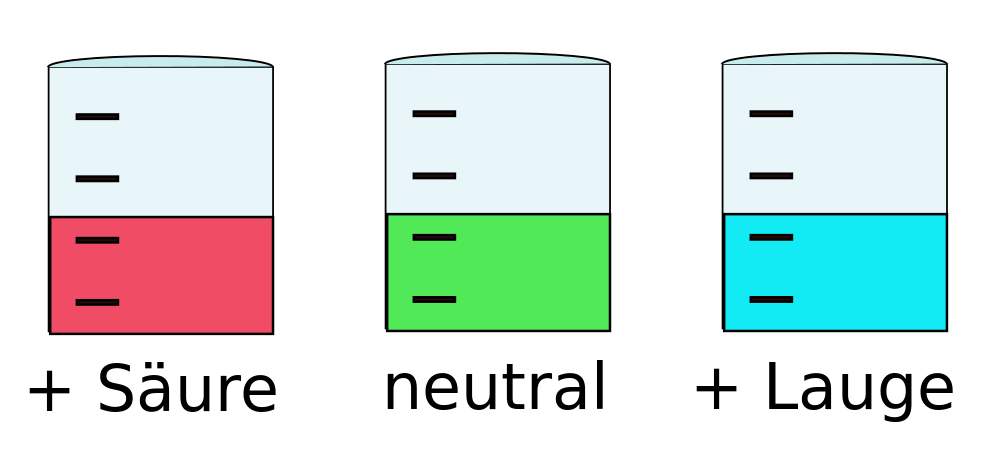
Saure Lösungen schmecken sauer, färben Rotkrautwasser rot und leiten elektrischen Strom, weil sie Ionen enthalten.
Säuren besitzen zudem mindestens ein Wasserstoffatom, das leicht abgespalten werden kann.
Dabei gilt der Grundsatz, je leichter es abgespalten werden kann, desto stärker ist die daraus entstehende saure Lösung.
Hinsichtlich ihrer Anwendung werden saure Lösungen vor allem als Bestandteil vieler Reinigungsmittel verwendet.
Es folgt ein Überblick über die wichtigsten Anwendungen von anorganischen Säuren:
| Säure: | Verwendung: |
| Zitronensäure | Reinigungsmittel |
| Schwefelsäure | Autobatterie |
| Salzsäure | Entkalker |
| Kohlensäure | Mineralwasser |
| Salpetersäure | Nachweis von Gold |
| Phosphorsäure | Rostlöser |
Basische Lösung:
Eine basische Lösung entsteht, wenn sich ein Metalloxid (Kalium, Magnesium, Natrium) mit Wasser verbindet.
Sie ist das Gegenstück zu einer sauren Lösung und kann diese neutralisieren.
Beim Vorgang der Neutralisation entsteht Wärme.
Basische Lösungen fühlen sich seifenartig an, weil die Zellen der Hornhaut bei Berührung aufquellen.
Sie werden auch als Laugen bezeichnet, färben Rotkrautwasser blau oder grün und leiten Strom, weil sie Ionen enthalten.
Beispiele für die Anwendung von schwachen Laugen auf Sodabasis sind Kernseifen und Waschmittel.
Salmiakgeist hingegen wird zur Fensterreinigung verwendet.
Und hoch konzentrierte Natronlauge verwendet man zum Reinigen von Rohren, wenn diese verstopft sind.
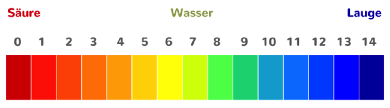
Der pH-Wert von Lösungen:
Der pH-Wert misst die Konzentration von Wasserstoff-Ionen (H+-Ionen) und Hydroxid-Ionen (OH–-Ionen) in einer Lösung.
Während die Wasserstoff-Ionen für die saure Reaktion verantwortlich sind, beschreiben die Hydroxid-Ionen die basische Reaktion.
Die Konzentration ist dabei als negativer dekadischer Logarithmus angegeben.
Der pH-Wert ist umso größer, je weniger Wasserstoff-Ionen (Säure) in einer Lösung vorhanden sind.
Man erkennt damit, wie stark sauer oder basisch eine Lösung reagiert.
Neutrale Lösungen enthalten gleich viele Wasserstoff-Ionen (H+-Ionen) und Hydroxid-Ionen (OH–-Ionen).
Saure Lösungen enthalten mehr Wasserstoff-Ionen (H+-Ionen) als Hydroxid-Ionen (OH–-Ionen), basische Lösungen weniger.
Der pH-Wert reicht von einer Skala von 0 bis 14.
Reines Wasser und neutrale Lösungen haben den pH-Wert 7.
Saure Lösungen haben einen pH-Wert < 7 (Farbe rot auf der höchsten Stufe 0).
Basische Lösungen haben einen pH-Wert > 7 (Farbe blau auf der höchsten Stufe 14).
Hier erhältst du noch weitere Informationen:
https://de.wikipedia.org/wiki/S%C3%A4ure-Base-Konzepte
Tests:
- Basische Lösungen Überblick Übung
- Chemie pH-Wert Definition Übung
- Saure Lösungen Überblick Übung
- Wichtige Säuren und ihre Verwendung Übung
- Chemie pH-Wert Messung Skala Übung
PDF-Übungsblätter zum Ausdrucken:
- Saure Lösungen Überblick Übungsblatt
- Basische Lösungen Überblick Übungsblatt
- Saure und basische Lösungen Merkblatt
- Saure und basische Lösungen Fragen Übungsblatt