Definition: Moleküle
Unter Moleküle (lat. molecula = kleine Masse) versteht man elektrisch neutrale Teilchen, die aus zwei oder mehreren Atomen aufgebaut sind.
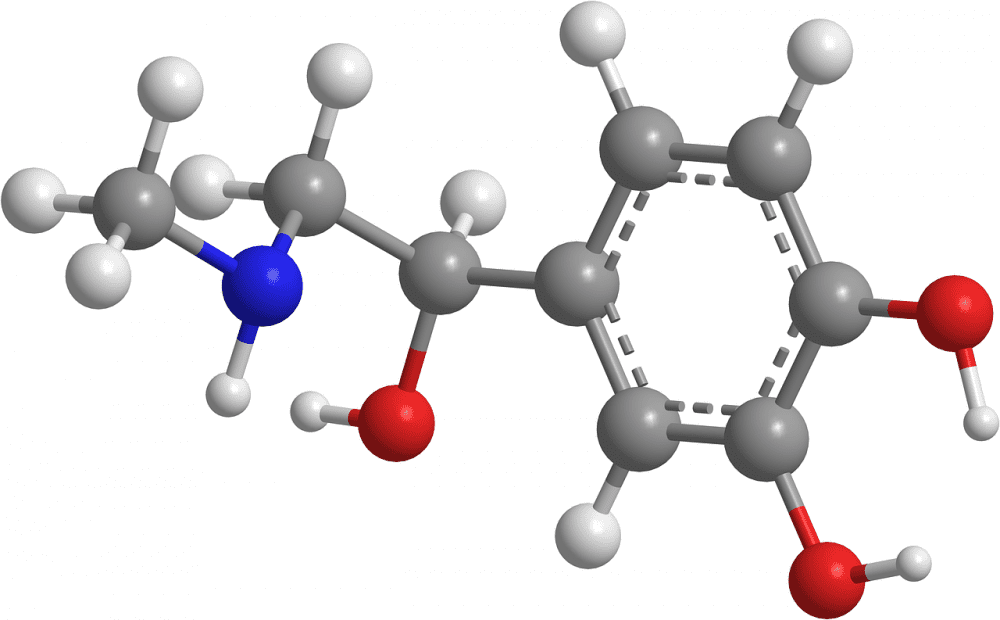
Abb. Adrenalin-Molekül – C9H13NO3
Diese werden durch chemische Bindungen zusammengehalten.
Sie bestehen entweder aus dem gleichen Atom z.B. Sauerstoff (O2), oder setzen sich aus verschiedenen Atomen zusammen z.B. Wasser (H20).
Eigenschaften Moleküle:
Die Anordnung der Atome in einem Molekül wird durch ihre chemischen Bindungen definiert.
Das Molekül ist kein starres Gebilde – Energiezufuhr führt zu Molekülschwingungen.
Der Sachverhalt das gleiche Summenformeln unterschiedliche Moleküle zulassen, wird Isometrie genannt.
Hinsichtlich der chemischen Eigenschaften übernimmt das einzelne Molekül die Eigenschaften des zugrundeliegenden Stoffes.
Hinsichtlich der physikalischen Eigenschaften (Siede- und Schmelzpunkt) sind die zwischenmolekularen Kräfte bestimmend.
Große Moleküle werden als Makromoleküle bezeichnet und kommen z.B. in Form von Kunststoffen wie PET vor.
Darstellungsweisen:
Moleküle können entweder in Formelschreibweisen, in Strukturformeln (zweidimensionalen Schemata) oder in Stereoformeln (dreidimensionalen Modelle) dargestellt werden.
Letztere besitzen den höchsten Informationsgehalt.
Beispiel an Propan (Darstellung laut Wikipedia):
a) Elektronenformel:
b) Valenzstrichformel:
c) Keilstrichformel:
d) Skelettformel:
e) Konstitutionsformel:
CH3–CH2–CH3
f) Summenformel
C3H8
Keine Molekülbildung:
Bei folgenden wichtigen chemischen Verbindungen liegen keine individuellen Molekülbildungen vor:
a) bei diamantartigen Stoffen:
Obwohl die Atome zwar durch kovalente Bindungen zusammengehalten werden, ist die chemische Formel nur eine Verhältnisformel.
Hier lässt sich die Anordnung der Atome durch eine wiederholende Elementarzelle darstellen.
Beispiele: Siliciumcarbid, Borcarbid, etc.
b) bei Salzen:
Hier spricht man von Atomverbänden mit Ladungen, die im engeren Sinne nicht Moleküle genannt werden.
Salze werden durch Teilchen mit einer Ladung zusammengehalten.
Diese Bindungen werden Ione genannt.
Beispiele: Natriumchlorid, Natriumsulfat, etc.
Tests:
Moleküle Definition und Beispiele Test
PDF-Übungsblätter:
10 Fragen zu Moleküle Übungsblatt
Chemie Moleküle Überblick Merkblatt
Chemie Moleküle Überblick Übungsblatt